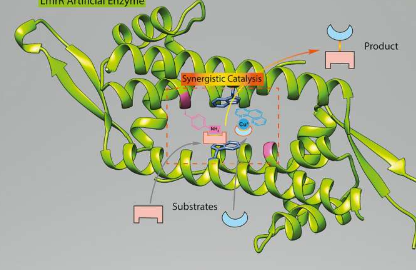
格罗宁根大学的科学家通过添加两种非生物催化成分:一种非天然氨基酸和一种催化铜络合物,将一种非酶蛋白转变为一种新型的人造酶。这是第一次使用两种非生物成分创建酶来创建活性位点。该研究表明,这种协同组合是实现催化作用的强大方法,而催化作用通常不在人工酶领域之内。该研究于2月10日发表在《自然催化》上。
酶是在温和条件下运行的天然催化剂。这使它们成为可能需要高温和高压以及有毒溶剂或金属的工业化学催化的有吸引力的替代方法。但是,并非所有的化学反应都可以被天然酶催化。修饰现有酶是一种选择,但格罗宁根大学生物分子化学教授杰拉德·罗尔夫斯(Gerard Roelfes)认为,创造新酶可能是另一种有价值的选择。
催化基团
“自然进化的酶催化特定的反应。适应需要那种的下放的酶。这就是为什么我们开创了新的,不自然的酶的创作,”他说。在2018年,他创造了非酶蛋白质,细菌转录因子LmrR,这可以在非天然氨基酸的插入之后形成非生物腙结构酸 p氨基苯丙氨酸。这是使用非天然氨基酸作为催化基团创建的第一个酶。
这次,Roelfes和他的博士后Zhi Zhou使用了相同的LmrR蛋白,并向其中添加了两种生物催化成分:一种是相同的非天然氨基酸对氨基苯丙氨酸,另一种是含铜的复合物。两者均可激活经典迈克尔加成反应的反应伙伴,该反应被广泛用于有机化学中以创建碳-碳键。Roelfes说:“但是他们俩都必须处于正确的位置,以有效和选择性地催化这种反应。” 仅将两个组件都添加到试管中是行不通的:“实际上,当它们太靠近时,它们会相互抵消。”
侧链
含铜复合物通过超分子键将其自身附着在甜甜圈状的LmrR蛋白上。“其位置取决于与蛋白质的相互作用,” Roelfes解释说。“从这个位置,我们确定了对氨基苯丙氨酸应插入蛋白质的哪个位置以产生一个活性位点。” 该氨基酸的催化部分是苯胺侧链。“根据我在有机化学中的经验,我知道该苯胺侧链在催化中的潜在用途,并预想将其与铜催化结合是可能的。” 当构建新的酶时,事实证明Roelfes的想法是正确的:经过改造的蛋白质原来是对迈克尔加成反应非常有选择性的催化剂。
Roelfes说:“这是对原理研究的证明。” “这种酶还不够快,无法用于实际应用,但是,通过标准技术,例如定向进化,可以改善这种情况。” 实验确实表明,可以使用两种生物催化剂来产生新的酶。其他类型的新型催化酶也可以类似的方式产生。Roelfes说:“我们使用的方法要求插入非天然氨基酸的分子生物学技术可以被像我们这样的化学家使用,” 现在就是这种情况,他的小组的科学家们正在尝试创造更多的人造酶。
迄今为止,向酶中添加非天然氨基酸已被广泛用于研究催化机理和探究酶的结构-功能关系。最近,罗尔夫斯(Roelfes)和他的前博士学位一起在《自然催化》中发表了一篇《观点》文章。IvanaDrienovská的学生(现就读于格拉茨工业大学)描述了基因编码的非规范氨基酸在酶中的用途。“对我来说,新生代酶的产生是最令人兴奋的选择。”